Hiện nay có nhiều phương pháp được ứng dụng trong điều trị và tiên lượng đối với những bệnh nhân nhiễm HIV, tuy nhiên, các phương pháp này có nhược điểm chung là không thể loại trừ virus HIV ra khỏi cơ thể người bệnh và gây ra những tác dụng phụ. Để giải quyết những hạn chế này, phương án tiếp cận theo hướng sử dụng các tế bào gốc máu đa dòng (hematopoietic stem cell - HSC) có khả năng tự đổi mới là một hướng điều trị lý tưởng, đảm bảo độ an toàn và có tiềm năng mở rộng cao.
Một vài nét về các phương pháp ức chế gen đích trong điều trị HIV
Hiện nay, phương pháp kháng retrovirus hoạt tính cao (HAART) đã được phát triển rộng rãi trong điều trị và tiên lượng đối với những người nhiễm HIV, phương pháp này có khả năng ngăn chặn hiệu quả sự tái bản và giảm lượng virus tạo ra. Tuy nhiên, HAART có nhược điểm là không thể loại trừ virus ra khỏi cơ thể và gây ra nhiều tác dụng phụ. Các cá thể có khả năng kháng thuốc sẽ nhanh chóng có lượng virus lớn hơn trong cơ thể và cuối cùng phát triển thành AIDS. Do đó, việc tìm ra một phương pháp có khả năng chữa trị được HIV vẫn là mối ưu tiên hàng đầu trong lĩnh vực HIV/AIDS.
Một số phương pháp có thể được sử dụng trong chữa trị HIV như: loại bỏ tất cả các tế bào bị nhiễm HIV dạng hoạt động hoặc tiềm tàng, chống lại sự lan rộng của HIV bằng cách phá hủy - ức chế các thụ thể trên màng tế bào - là trung gian cho HIV xâm nhập vào các tế bào khỏe mạnh. Một phương pháp khác có thể được sử dụng đó là bất hoạt lâu dài hệ gen của HIV trong các tế bào bị nhiễm - đây là một con đường khác tiến tới chữa trị HIV. Phương pháp này có thể được thực hiện bằng cách tạo ra những enzyme phát hiện có chọn lọc, sau đó phá hủy - bất hoạt một trình tự virus đặc hiệu, từ đó có khả năng ức chế sự nhân lên của virus cũng như sự lan rộng của chúng mà không gây độc đến tế bào chủ.
Ức chế hệ gen là một quá trình mà trong đó một locus gen cụ thể bị biến đổi nhằm mục đích ngăn chặn hoặc thay đổi chức năng bình thường của nó. Quá trình này được thực hiện bằng các kỹ thuật dựa trên tái tổ hợp tương đồng (HR), hoặc locus gen đích bị cắt đặc hiệu sau đó được sửa chữa không chính xác bằng bộ máy sửa chữa ADN của tế bào, ngoài ra trình tự ADN đích cũng có thể được cắt bỏ bằng enzyme tái tổ hợp đặc hiệu (site specific recombinase - SSR).
Cho tới nay, có 2 hướng trong điều trị HIV sử dụng yếu tố ức chế gen đó là: ức chế HIV thông qua bất hoạt gen của vật chủ và ức chế trực tiếp gen đích của virus HIV. Trong phương pháp bất hoạt gen của tế bào chủ, CCR5 và CXCR4 là các thụ thể trên tế bào đối với virus HIV - đây cũng là các đại diện đích tuyệt vời cho các liệu pháp can thiệp. Có nhiều nghiên cứu đã được tiến hành với hướng đích là các thụ thể CCR5 và CXCR4. CCR5 thực sự không cần thiết đối với chức năng thông thường của hệ miễn dịch. Bất hoạt CCR5 có thể làm giảm độ nhạy đối với nhiễm HIV, do đó đây cũng là một liệu pháp trong kháng HIV. Tuy nhiên, khác với CCR5, CXCR4 lại có vai trò nhất định đối với các quá trình sinh lý của cơ thể, bao gồm sự phát triển của tủy xương và các hạch bạch huyết. Tuy vậy, các nhà khoa học cũng đã có những nghiên cứu trên chuột bị “knock-out” CXCR4, và bất hoạt CXCR4 trong các tế bào tiền thân của tế bào T đã khiến cho cơ thể kháng lại được sự nhiễm HIV.
Đối với phương án ức chế trực tiếp hệ gen của virus HIV, virus HIV có nhiều gen cần thiết cho sự sinh sôi - phát triển và có một bản phiên mã duy nhất mã hóa cho nhiều protein, đây là một đích hiệu quả cho mục tiêu ức chế hệ gen. Ngoài ra, ức chế hệ gen của virus HIV không ảnh hưởng tới sự sống của tế bào chủ, điều này được ưa chuộng hơn bởi không dẫn tới hậu quả là mất đi các tế bào đóng vai trò quan trọng đối với hệ miễn dịch của vật chủ.
Biến đổi các tế bào gốc máu sử dụng phương pháp ức chế gen đích trong điều trị HIV
Hiện nay, các liệu pháp kháng lại HIV vẫn còn nhiều hạn chế do virus không hoàn toàn bị ức chế, gây ra những tác dụng phụ và có tương tác giữa các loại thuốc với nhau cho nên không phải bệnh nhân nào cũng có khả năng theo phác đồ điều trị một cách vô thời hạn. Những hạn chế nêu trên làm giảm tia hy vọng về khả năng sống lâu dài của nhiều bệnh nhân. Để giải quyết những thiếu sót này, phương án tiếp cận theo hướng sử dụng các HSC có khả năng tự đổi mới là một hướng điều trị lý tưởng, đảm bảo độ an toàn và có tiềm năng mở rộng cao.
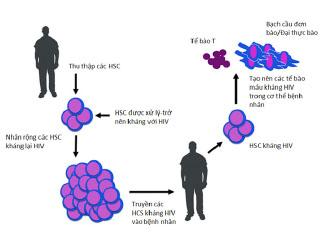
Sau khi chuyển các HSC đã bị biến đổi, cơ thể vật chủ có thể tái thiết lập một hệ thống tạo máu có khả năng miễn nhiễm với virus HIV, trong đó bao gồm cả các tế bào T CD4+ và các đích khác thuộc tủy xương. Đây là phương pháp có thể cứu chữa và đảm bảo cuộc sống lâu dài cho các bệnh nhân nhiễm HIV. Các bước thực hiện trị liệu cho bệnh nhân HIV theo liệu pháp gen sử dụng HSC được mô tả trong hình 1.
Sau khi thu được đủ lượng quần thể các HSC, có 2 hướng tiếp cận để đưa các gen ngoại lai có chức năng vào các tế bào này một cách hiệu quả và ổn định: sử dụng các hệ vector tích hợp - cho phép đưa các gen kháng HIV vào hệ gen của HSC hoặc sử dụng các hệ vector không tích hợp - các hệ vector dạng này sẽ đưa các enzyme có tác dụng gây bất hoạt gen hoặc gây ra tái tổ hợp tương đồng trong HSC. Các hệ vector tích hợp (intergrating vector system) hiện nay được sử dụng để chuyển gen hiệu quả và ổn định vào HSC là: vector dạng giả virus (GALV, RD114), vector lentivirus từ HIV, vector bọt virus và các dạng giả VSV-G khác nhau. Hiện nay, hướng tập trung chính trong việc tối ưu hóa các hệ thống vector tích hợp đang chuyển sang mục tiêu an toàn cao, bởi vì các hệ vector thường có thể liên quan tới độc gen và gây nguy cơ cao hình thành khối u ác tính. Với nhiều cải tiến, hiện nay vector lentivirus và bọt virus đang là những hệ vector với rất ít nguy cơ gây u ác tính. Bên cạnh đó, các hệ vector không tích hợp lại có ưu thế là tránh được nguy cơ gây u ác tính. Các hệ vector dạng này đặc biệt phù hợp với việc chuyển ZFN (Zinc Finger Nuclease) hoặc các enzyme sửa chữa ADN khác, kết quả là kích thích sự loại bỏ lâu dài gen đích nào đó sau khi chỉ biểu hiện tạm thời.
Hiện nay, có hai hướng tiếp cận trong việc thay đổi hệ gen đích của HSC để chữa trị HIV:
Ức chế có chủ đích các gen hỗ trợ cho HIV xâm nhập (ví dụ như đồng thụ thể CCR5): CCR5 là một chemokine đóng vai trò như một đồng thụ thể quan trọng trong quá trình xâm nhập của các chủng HIV-R5. CCR5 không cần thiết đối với hệ miễn dịch, một dạng đột biến của CCR5 là ∆32 tồn tại ở 5-14% các cá thể người châu Âu và ít phổ biến hơn ở người châu Phi hay châu Á. Đột biến ∆32 dạng dị hợp tử giúp cho tiến triển của HIV chậm hơn ở các bệnh nhân, các cá thể mang đột biến này ở dạng đồng hợp tử có khả năng kháng lại lây nhiễm HIV. Vì lý do này, CCR5 là đích kháng virus HIV đáng quan tâm. Đồng thời CCR5 cũng đã được nghiên cứu sâu trong các liệu pháp về tế bào gốc. Sử dụng các protein sửa chữa ADN như ZNF, TALEN (Transcription Activator Like Endonuclease) hay HE (Homing Endonuclease), các nhà khoa học đã có thể làm biến đổi gen đích CCR5 trong bất kỳ dạng tế bào nào, bao gồm cả các tế bào gốc máu có nguồn gốc từ chính bệnh nhân. Các nghiên cứu khởi đầu đã sử dụng ZFN để bất hoạt CCR5 trong các tiền tế bào T của người. Trong các nghiên cứu về sau, ZFN được sử dụng bất hoạt CCR5 trong các HSC của người, các tế bào này sau đó được kiểm nghiệm trên mô hình chuột mô phỏng nhiễm HIV. Sau khi các thí nghiệm cho kết quả nhiều hứa hẹn, các thử nghiệm lâm sàng của ZFN hướng đích tới CCR5 trong các tế bào T hiện đang được tiến hành.
Đưa vào tế bào các gen có chức năng can thiệp quá trình xâm nhập hoặc tái bản của HIV (ví dụ như nhân tố ức chế dung hợp hoặc các yếu tố giới hạn của tế bào chủ): nghiên cứu lâm sàng ban đầu đã sử dụng các tế bào T tự thân - biểu hiện C46 (có khả năng kháng lại sự xâm nhập của HIV) trên 10 bệnh nhân, kết quả cho thấy liệu pháp này là khả thi. Các yếu tố ngoại lai cũng được sử dụng trong việc can thiệp vào các quá trình khác của virus. Trong các tế bào gốc, protein điều hòa Rev được biến đổi thành dạng đột biến - dạng Rev trans có tính trội. Ngoài ra, mồi đích được sử dụng để ức chế sự sao chép của virus trong các tế bào gốc thông qua việc kết hợp và làm cô lập yếu tố hoạt hóa gen Tat. Việc tích hợp vào ADN của virus được thực hiện trực tiếp thông qua sử dụng các enzyme recombinase cải tiến hoặc Homing endonuclease (HE).
Thay cho lời kết
Mặc dù đã có nhiều kết quả đáng khích lệ nhưng việc đưa các yếu tố di truyền ngoại lai kháng HIV vào HSC trong chữa trị HIV nhưng cũng còn có những khó khăn và lo ngại như: khi thêm các gen cùng với promoter của riêng chúng sẽ tạo nên nguy cơ biểu hiện lâu dài hoặc gây hoạt hóa các gen liền kề với nó; các protein ngoại lai khi biểu hiện có thể tạo nên phản ứng miễn dịch trong cơ thể người nhận, từ đó giới hạn sự nhân lên và thời gian sống của các tế bào đã bị biến đổi; phương pháp biến đổi gen tế bào gốc máu là một can thiệp đắt đỏ (có thể mất khoảng vài trăm ngàn USD cho mỗi bệnh nhân)... Tuy nhiên, với những nỗ lực nghiên cứu về liệu pháp gen trên HSC đang được thực hiện, trong tương lai phương pháp này sẽ chứng minh được tính hiệu quả và thực sự tạo nên đột phá trong việc cứu chữa các bệnh nhân mắc căn bệnh thế kỷ này.
Nguồn: khoahocvacongnghevietnam.com.vn